Tiempo estimado de lectura: 4 minutos
Los coloides, también conocidos como suspensiones o dispersiones coloidales, son sistemas conformados por dos o más fases. Una de estas fases es continua y puede ser un líquido o un gas, y la otra fase son partículas sólidas muy finas y que se encuentran dispersas, y en menor proporción, y en algunos casos también es una solución líquida. Hoy te contaremos qué son los coloides, dónde se encuentran y cómo se tratan químicamente.




¿Qué son los coloides?
El término coloide proviene del griego “kolas”, que significa «que puede pegarse». Su nombre se refiere a uno de los atributos de los coloides, que es una tendencia espontánea para formar coágulos. Los coloides son fluidos pastosos, viscosos, contaminantes, que afectan al punto de ebullición del agua. Se diferencian de otras suspensiones químicas en el tamaño de las partículas de la fase dispersa; estas no son visibles de forma directa, se necesita un microscópico para visualizarlas. En otras suspensiones químicas las fases se separan, pero en las coloidales no hay esta separación, y tampoco se pueden filtrar. Las partículas de los sistemas coloidales tienen tamaños de entre 10 y 2000 Å, son sistemas no homogéneos, las partículas están dispersas sin estar unidas a las moléculas y no se sedimentan al dejarlas en reposo.Tipos de coloides
Los coloides se clasifican con base en la atracción entre la fase continua y la dispersa. Los sistemas coloidales son:- Emulsiones. Son suspensiones coloidales de un líquido en otro inmiscible, donde tanto la fase continua como la dispersa son líquidas. Las emulsiones se preparan agitando la mezcla con dos líquidos, o pasando la muestra por un molino coloidal homogenizador.
- Soles. Son suspensiones en los que ambas fases son líquidas, relativamente inestables y pueden coagularse o precipitarse si se eleva la temperatura o se añade una pequeña cantidad de electrolitos. Los soles se subdividen en liófobos, que tienen poca atracción entre la fase dispersa y el medio dispersante, por lo que son cinéticamente inestables; y en liófilos, que tienen una gran atracción entre ambas fases por lo que son estables.
- Aerosoles. Son sistemas coloidales con partículas en estado sólido o líquido que están dispersas en un gas.
- Espumas. Son sistemas en los que la fase continua puede ser sólida o líquida, y la fase dispersa es un gas.
| Clases de coloides | Medio dispersante | Ejemplo |
| Soles, geles | Líquido | Pintura, gelatina |
| Emulsiones | Líquido | Leche, mayonesa, cremas |
| Espumas | Líquido | Espuma de jabón, crema batida |
| Aerosoles líquidos | Gas | Neblina, nubes |
¿Cómo se preparan los coloides?
Por dispersión. La dispersión de partículas grandes a las dimensiones coloidales mediante pulverización, molienda o cizallamiento. Por condensación. Las partículas pequeñas disueltas en coloidales más grandes por condensación se utilizan para preparar sílice u oro coloidal. En general, encontramos sistemas coloidales en todos los tejidos vivos; el suelo se conforma de materia coloidal y también está en alimentos como la leche, el queso, la mantequilla, las sopas, las jaleas y gelatinas, en la nata, entre otros.Uso de los coloides
En la industria se utilizan mucho los sistemas coloidales para la elaboración de:- Caucho
- Plástico
- Pinturas
- Lacas
- Barnices
- Cerámica
- Textiles
- Papel
- Películas fotográficas
- Cementos
- Gomas
- Cuero
- Tintas
- Jabones
- Lubricantes
- Insecticidas de uso agrícola
- Flotación de minerales
- Productos para blanqueamiento
- Detergentes

Coloides en jabones y detergentes
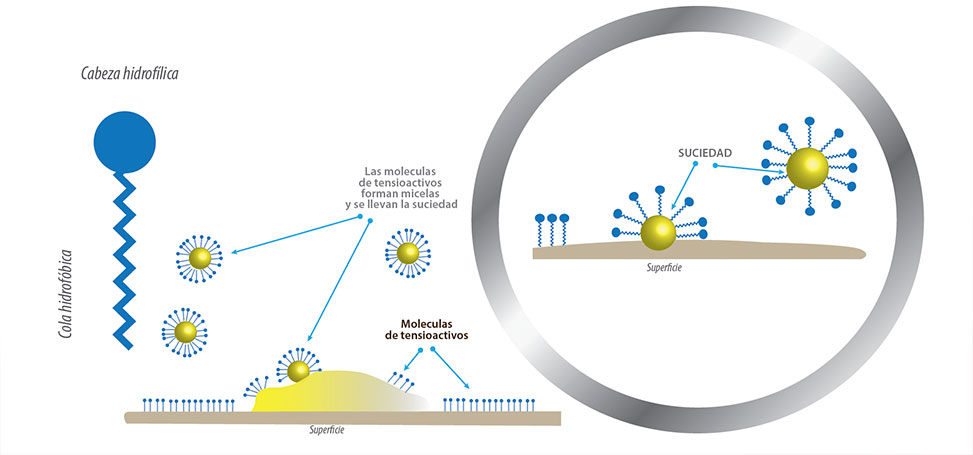
Nuestros antepasados fabricaban jabones a partir de cenizas o de grasas animales. Los pioneros elaboraban jabones hirviendo las grasas en soluciones básicas con grasas de animales, carbonato de potasio o con cenizas de madera con agua caliente. Las grasas de origen animal contienen poliésteres de ácidos grasos, que son ácidos carboxílicos de cadena larga, y cuando se tratan con una base como el carbonato de potasio, o el hidróxido de sodio, forman glicerol y sales de ácidos grasos, como el ácido oleico, esteárico y palmítico, que también se conocen como jabones.Modo de acción de los limpiadores coloidales
Los jabones tienen un extremo no polar lipofílico y un extremo iónico hidrofílico, el cual es un grupo carboxilato, y la longitud de la cadena varía de un jabón a otro. Por su parte, los detergentes también tienen cadenas de hidrocarburos no polares y un grupo iónico. Mientras que los jabones forman compuestos insolubles de magnesio y calcio en el agua, los detergentes forman compuestos solubles. La acción limpiadora de jabones y detergentes es determinada por la estructura de las moléculas involucradas. El extremo no polar de hidrocarburo se disuelve o es atraído por otras sustancias no polares como la suciedad, que tiene partículas de grasa o aceite. El extremo iónico o polar es atraído por el agua, de modo que las moléculas actúan como un puente entre la materia polar y la no polar, de modo que se suspenden como partículas coloidales que limpian y se eliminan con facilidad.